[拼音]:xiangpingheng
[外文]:phase equilibrium
多相系统中各相变化达到的极限状态。此时在宏观上已经没有任何物质在相际传递,但在微观上仍有方向相反的物质在相际传递,且速度相等,故传递的净速度为零。化工热力学研究的两相系统的平衡,有气液平衡、气固平衡、汽液平衡、汽固平衡、液液平衡、液固平衡和固固平衡;相数多于二的系统,有气液固平衡、汽液液平衡等。系统处于相平衡状态时,各相的温度、压力都相同,它们的组成一般不相同。相平衡的研究主要是通过实验测定有关数据,并应用相平衡关联的方法,以探讨平衡时温度T、压力p和各相组成(摩尔分率x、y)之间的关系,借以判断一定条件下相变化过程的方向,并根据偏离相平衡的程度来估计过程推动力的大小。相平衡是传质分离过程和热质传递过程的理论基础之一。例如:蒸馏和吸收利用相平衡时汽液或气液两相组成不同,通过相际物质传递来实现混合物的分离;萃取根据物质在两个不互溶或部分互溶的液相中溶解度的不同来实现混合物的分离;结晶利用固体在液体中溶解度的限制,从溶液中析出固体。这些过程都涉及物质在相际的传递。研究相平衡可为选择合适的分离方法提供依据。在传质设备(如精馏设备、萃取设备)的计算中,可用相平衡数据来计算设备的平衡级数或传质单元数。此外,相平衡研究还用于探讨诸如玻璃、陶瓷、耐火材料、合金等材料的形成条件。
相律即相平衡系统自由度的规律。温度、压力和各相组成等都是与系统大小无关的强度性质,其中一部分是独立变量,其余则是从属变量。强度性质中的独立变量数称为自由度F。根据热力学导得的相平衡准则,可得出:
F=K-P+2-R
式中K为组分数;P为相数;R为独立的化学反应数(仅在同时涉及化学平衡时才有此项) 。如关于三组分系统的汽液平衡,F=3-2+2-0=3;当已知液相组成时仅确定了两个变量x1和x2(因x3=1-x1-x2,不是独立变量),因而系统尚未确定。根据相律可知,还有一个自由度,故必须再给定温度、压力或汽相中任一组分的摩尔分率,系统才完全确定。
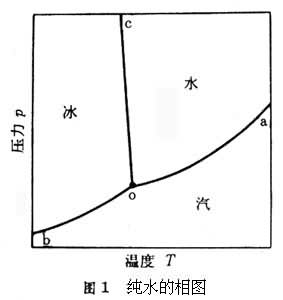
相图将实验测得平衡条件下的温度、压力和各相组成的数据绘成曲线图,即为相图。如纯水的相图(图1),以温度T和压力p为坐标轴。图中曲线oa、ob、oc分别表示汽液、汽固、液固相平衡时的温度和压力的关系。对这个两相系统,根据相律得F=1,即只有一个独立变量,表明压力为温度的单值函数,对于汽液、汽固平衡,压力即蒸气压,这时此函数常用蒸气压方程表示。在o点,汽液固三相共存,称为三相点。在此点F=0,表明温度、压力都不能变动。又如甲苯(A)-苯(B)二元系在101.325kPa(1大气压)下的等压汽液平衡相图(图2),以温度和组成(苯的摩尔分率) x为坐标轴。上下两条曲线分别为汽相线和液相线,分别表示苯在不同温度下与甲苯平衡时的汽相组成y和液相组成x。水-氯化钠-氯化钾三元系在100°C下的液固平衡相图 (图3)采用三角形坐标,三个顶点表示三个纯组分,三条边分别表示三个相应的二元系(其组成以质量百分数m%表示),三角形内部任何一点都表示三元系。曲线 IEJ表示与固体达到平衡时的饱和液体组成。在IE线上固体是纯氯化钠,在JE线上固体是纯氯化钾;只有在E点,液相与固体氯化钠和氯化钾同时达到平衡。

 相平衡准则
相平衡准则
从热力学第二定律导出的可以判别一多相系统是否已经达到平衡的准则。相平衡准则指出:当 α相和β相处于相平衡时,任一组分在两相中的化学位或逸度相等。数学表达式为:

式中μ姦和μ婑分别为任一组分 i在α相和β相中的化学位,即偏摩尔自由焓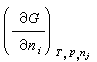 (在温度、压力以及除i组分外其余任意组分j的摩尔数不变时,自由焓G对i组分摩尔数ni的偏导数;其中G=U+pV-TS,U为内能,S为熵,V为体积);弙姦和弙婑分别为i组分在α相和β相中的逸度。逸度与化学位的关系为:
(在温度、压力以及除i组分外其余任意组分j的摩尔数不变时,自由焓G对i组分摩尔数ni的偏导数;其中G=U+pV-TS,U为内能,S为熵,V为体积);弙姦和弙婑分别为i组分在α相和β相中的逸度。逸度与化学位的关系为:

式中μ孂为101.325kPa(1大气压)下i组分处于理想气体状态的化学位。μi和 弙i都是温度、压力和组成的函数。化学位或逸度可看作是物质从一相逸出进入另一相的推动力。相平衡准则又是相平衡计算的基本公式。当已知μi或弙i与T、p、x的关系时,就可由一相组成计算另一相的组成(见相平衡关联)。弙i与T、p、x具体关系的确定已超出经典热力学的范畴,须用统计力学或半经验模型的方法并结合实验来确定。