我国土壤和水体中重金属污染问题日益严重,如湖南和广西相继发生较为严重的重金属污染事件。这与金属矿山的不规范开采、冶炼、电镀工业废水排放及使用重金属制品等有关〔1〕。印染、电镀、金属加工行业和铜铬矿的开采等大量涉及铜和铬的化合物,它们在水中主要以Cu2+、Cr3+和Cr6+形式存在,是常见的重金属离子。重金属离子不仅对局部环境造成污染,对人体健康和生态环境也构成较大危害,因此净化含铜、铬废水是需要解决的重要环境问题之一〔2, 3〕。
目前去除水中重金属常用的方法有化学沉淀法、吸附法、微电解—混凝沉淀法〔4〕。其中,化学沉淀法处理费用高,日常维护困难,限制了其广泛应用。微电解—混凝沉淀法能耗高,且对低浓度重金属的去除效果不是很好〔5〕。这些方法虽然可以有效处理废水,但在实际应用中存在一定缺点。利用改性沸石处理废水是有效的处理方法之一〔6〕。通过NaOH碱熔法处理天然斜发沸石,可改变其硅铝比,得到的改性斜发沸石对阳离子的吸附交换能力有所提高。研究结果表明,改性沸石对高浓度氨氮废水有较好的去除效果〔7〕,因此笔者采用改性沸石去除废水中的Cu2+和Cr3+,为其在实际治理同类工业废水的应用提供理论依据。
1 实验方法
1.1 仪器与试剂
78HW-1恒温磁力搅拌器,江苏金坛市医疗仪器厂;TDX01陶瓷纤维马弗炉,北京美诚科贸集团;752紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;硝酸铜、硝酸铬,分析纯。
1.2 Cu2+与Cr3+浓度的测定方法
向一定浓度的含Cu2+溶液中加入一定量的醋酸-醋酸钠缓冲溶液(pH约为5.5~6.0),将溶液加热到约80 ℃,加入几滴0.2% PAN指示剂,溶液呈紫红色,再用浓度为0.100 mol/L的EDTA-2Na溶液进行滴定,待溶液变为亮绿色即为滴定终点,根据EDTA-2Na溶液用量得到Cu2+浓度。
在硫酸和磷酸混合液中〔1 L,V(硫酸)∶V(磷酸)∶V(水)=15∶15∶70〕,三价铬呈蓝色,其最大吸光度为580 nm〔8〕。配制不同浓度的含Cr3+溶液,用分光光度法测定溶液吸光度,并绘制标准曲线测定Cr3+。
1.3 斜发沸石改性实验
采用文献〔7〕的碱熔-水热改性方法和最佳改性条件,对天然斜发沸石进行改性。分别称取3.0 g NaOH和3.0 g斜发沸石,置于镍坩埚中混合均匀,放入马弗炉中在450 ℃下熔融2 h,冷至室温后倒入水热釜中并加入75 mL蒸馏水,将水热釜放入烘箱中于100 ℃下处理6 h,冷至室温后抽滤、风干,再将固体分散到50 mL 3 mol/L的NaCl溶液中,并调节溶液pH约为7,放入锥形瓶搅拌4 h,再次抽滤、风干,得到改性沸石。
1.4 改性沸石吸附实验
(1)改性沸石吸附Cu2+实验。将12.080 0 g Cu(NO3)2·3H2O 溶于水,移入500 mL容量瓶中,稀释至标线,得到模拟废水,其Cu2+质量浓度为6 400 mg/L。将一定量的改性沸石放入25 mL含Cu2+模拟废水中,密封并进行搅拌,搅拌至所需时间后离心,取清液测定Cu2+浓度,按式(1)、式(2)计算吸附量及去除率。

式中:q——吸附量,mg/g;
c0——初始离子质量浓度,mg/L;
c——吸附平衡后溶液中残留离子质量浓度,mg/L;
V——溶液体积,L;
m——改性沸石的质量,g。
(2)改性沸石吸附Cr3+实验。将24.009 0 gCr(NO3)3·9H2O 溶于水,移入1 L容量瓶中,稀释至标线,得到模拟废水,Cr3+质量浓度为3 000 mg/L。将一定量的改性沸石放入25 mL含Cr3+模拟废水中,密封并搅拌,搅拌至所需时间后离心,取清液测定Cr3+浓度,按式(1)、式(2)计算吸附量与去除率。
1.5 改性沸石再生实验
改性斜发沸石吸附Cu2+饱和后,风干,分别用NaCl溶液(3 mol/L)、NaCl溶液(3 mol/L)+氨水(质量分数1%~2%)对其进行再生。将饱和改性沸石放入再生液中搅拌4 h,过滤,干燥,然后用再生沸石对质量浓度为6 400 mg/L的含Cu2+溶液进行吸附实验。
2 结果与讨论
2.1 改性后斜发沸石的结构
斜发沸石〔Na6(Al6Si30O72)·24H2O〕是自然界中分布最广的沸石矿物之一,具有吸附和离子交换性能而被广泛应用。但由于天然斜发沸石中无定型物质及其他结晶物的存在,使其难以发挥最大的吸附及离子交换能力。对天然斜发沸石进行改性,尤其是碱改性,可大大改善和提高斜发沸石的吸附能力及离子交换性能。沸石的主要结构单元是硅氧与铝氧四面体,由于铝为正三价,铝氧四面体带有一个负电荷。为平衡电荷,必然有相应的阳离子进入沸石体系,沸石对阳离子的吸附和交换性能与其铝氧四面体密切相关。用碱调整沸石的硅铝比,可以改变沸石的离子吸附交换能力,达到改性目的。
采用碱熔-水热法改性后,斜发沸石的晶型发生了改变,转化成Na-P型分子筛〔7〕,硅铝比降低,骨架内氧负电荷增强,吸附交换阳离子的能力也随之增强。
2.2 改性沸石投加量对Cu2+和Cr3+去除率的影响
向25 mL质量浓度分别为6 400、3 000 mg/L的含Cu2+、Cr3+水样中分别加入不同量的改性沸石,搅拌吸附10 min,考察改性沸石投加量对Cu2+和Cr3+去除效果的影响。当改性沸石投加量分别为0.5~3.0 g、0.5~1.0 g时,随着投加量的增加,其对模拟废水中Cu2+和Cr3+的去除率均逐渐增大。当改性沸石投加量分别为3.0、1.0 g时,其对Cu2+、Cr3+的去除率达到最大值,分别为88.0%、87.4%,此时改性沸石投加量与水样中Cu2+、Cr3+的质量比分别为18.75∶1、13.33∶1。当投加量继续增加,去除率趋于平稳。
2.3 吸附时间对Cu2+和Cr3+去除率的影响
向25 mL质量浓度分别为6 400、3 000 mg/L的含Cu2+、Cr3+水样中加入1.0 g改性斜发沸石,考察吸附时间对Cu2+和Cr3+去除效果的影响。由实验结果得出,改性沸石对Cu2+和Cr3+的吸附大致可分为两个阶段,快速吸附阶段与缓慢吸附阶段。对于Cu2+,吸附时间>100 min后,Cu2+去除率变化趋于平缓且达到饱和吸附,其最大去除率为52.82%;而对于Cr3+,吸附时间>5 min后,Cr3+去除率变化趋于平缓,其最大去除率为82.50%。可见吸附Cr3+比吸附Cu2+达到平衡所需时间更短。
笔者认为上述现象主要与离子所带电荷大小有关。在吸附初期,吸附主要发生在改性沸石的外表面,这在短时间内就可以完成。随着吸附量的增加,吸附在改性沸石表面的金属离子产生的静电斥力也逐渐增强,使得溶液中的阳离子进入到改性沸石孔内部的阻力逐渐变大;当离子电荷量达到饱和时,吸附达到平衡,溶液中重金属的残留浓度基本不变,这时重金属离子去除率最大。相比Cu2+,Cr3+电荷更高,在沸石孔道内的扩散速度相对较快,因而达到饱和时的吸附时间较短。
2.4 吸附等温线
称取1.0 g改性斜发沸石若干份,分别置于250 mL锥形瓶中,室温下加入25 mL不同质量浓度的含Cu2+和Cr3+废水,于300 r/min的恒温搅拌器中搅拌,搅拌10 min后离心,取上层清液,测定剩余Cu2+、Cr3+质量浓度,计算吸附量,绘制吸附曲线。吸附量与溶液中Cu2+、Cr3+初始质量浓度及平衡质量浓度的关系如图 1、图 2所示。由图 1、图 2可见,达到吸附平衡时,离子初始质量浓度越大,溶液中Cu2+与Cr3+的平衡质量浓度就越高,但改性沸石对Cu2+和Cr3+的吸附量也越大。

图 1 Cu2+吸附量与初始质量浓度及平衡质量浓度的关系 
图 1 Cu2+吸附量与初始质量浓度及平衡质量浓度的关系
再以ln q对ln c作图,采用Freundich方程进行拟合,得到图 3。 
再以ln q对ln c作图,采用Freundich方程进行拟合,得到图 3。
从图 3可以看出,Freundich吸附等温线能够较好地拟合Cu2+、Cr3+在改性沸石的吸附过程,其拟合线性相关系数分别为0.988 48和 0.976 17,相关系数都>0.9,直线方程分别为y=0.207 85x+2.335 34和 y=0.482 44x+0.240 67,直线斜率分别为0.207 85与0.482 44,在0.1~0.5之间,表明用Freundlich模型来描述吸附平衡数据是合适的。
2.5 改性沸石的再生研究
对改性沸石进行再生实验,再生次数与Cu2+吸附量以及再生率的关系如图 4所示。
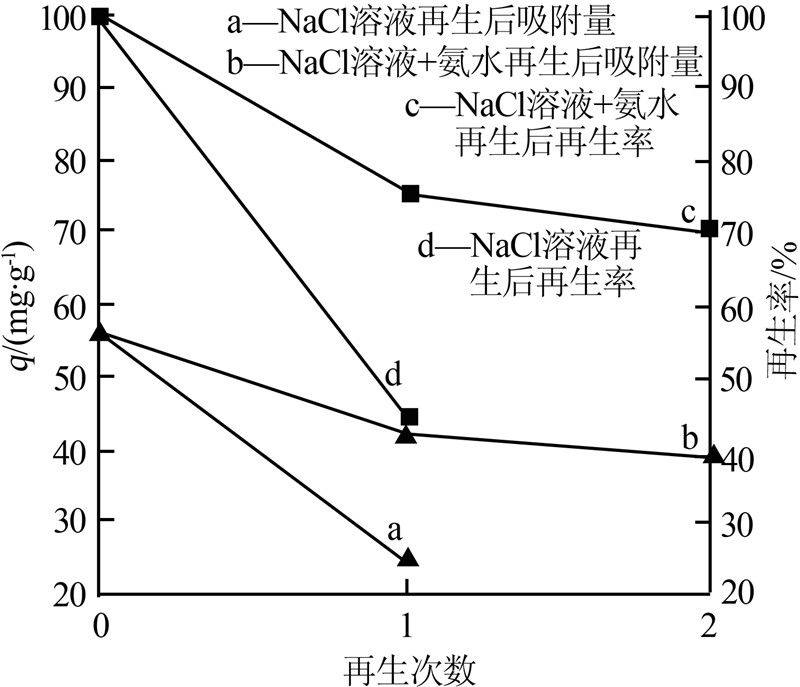
图 4 再生次数与Cu2+吸附量及再生率的关系
图 4中,曲线a、d分别代表NaCl溶液(3 mol/L)对吸附Cu2+饱和改性沸石进行再生后得到的吸附量和再生率,经过1次再生后,再生样品的再生率为44.66%,不是很理想(见曲线d)。
曲线b和c分别代表采用NaCl溶液+氨水对吸附Cu2+饱和改性沸石进行再生后得到的吸附量及再生率。第1次再生后,再生样品的再生率为75.00%,第2次再生后,再生样品的再生率为70.14%。因而用NaCl溶液+氨水对吸附Cu2+饱和的改性沸石进行再生是一个不错的选择,可以多次循环利用,节约了成本,同时可有效去除回收Cu2+。 。
3 结论
(1)天然沸石经过改性后,向着低硅铝比的Na-P型分子筛转化,对Cu2+、Cr3+吸附量增加。对于25 mL质量浓度分别为6 400、3 000 mg/L的含Cu2+、Cr3+水样,当改性沸石投加量分别为3.0、1.0 g时,其对Cu2+、Cr3+的去除率分别达到88.0%、87.4%,其最佳投加质量比为18.75∶1和13.33∶1。
(2)改性沸石对高浓度含Cu2+、Cr3+废水的吸附是个快速平衡过程,吸附时间分别为100、5 min时达到吸附平衡。
(3)改性沸石对高浓度含Cu2+、Cr3+废水的吸附量随离子初始质量浓度的增加而增大,且符合Freundich等温吸附模型,相关系数在0.9以上。
(4)用NaCl溶液(3 mol/L)+氨水对吸附Cu2+饱和的改性沸石进行再生,再生率比较高,可以多次循环利用。














